您当前的位置:药品通 > 中西药 > 拉替韦钾片(艾生特)
拉替韦钾片(艾生特) 网上报价

康德乐大药房CFDA
正品保证 全国连锁
正品保证 全国连锁
声明:药品通仅提供药品信息展示服务,不提供任何药品交易服务,价格信息均来自具备合法资质的网上药店。
药品通所展示药品信息仅供医学药学专业人士阅读、参考,如药品信息与您实际购买信息不同,请以实际购买信息为准。请仔细阅读药品、产品说明书或者在药师、医务人员指导下购买和使用,禁忌内容或者注意事项详见说明书。
| 药品名称 |
拉替韦钾片(艾生特)
已有0人点评
¥1980-1980
|
||
|---|---|---|---|
| 适应症 | |||
| 规格 | 400mg (按拉替拉韦计) | ||
| 厂家 | 默沙东 | ||
| 批准文号 | H20130672 | ||
| 功效主治 |
1.本品适用于与其它抗反转录病毒药物联合使用,用于治疗人免疫缺陷病毒(HIV-1)感染。 2.本品适应症的确立是基于对三个双盲临床对照研究48周时的血浆HIV-1 RNA水平进行的分析。这些研究中的两个是在接受过三种抗反转录病毒抑制剂治疗(非核苷类反转录酶抑制剂、核苷类反转录酶抑制剂、蛋白酶抑制剂)并有疾病临床进展的成年患者中进行的,另一个是在既往未治疗的患者中进行的。 3.本品与其他活性药物联合使用时产生治疗应答的可能性更大。(见临床试验)在儿童患者中尚无本品的安全性和有效性数据。 |
||
| 用法用量 | 用于治疗HIV-1感染者时,口服本品 400 mg,每日两次,餐前或餐后服用均可。 本品应与其他抗反转录病毒药物联合使用。 |
||
| 剂型 | 剂型_片剂 | ||
| 不良反应 | 成人 曾接受过治疗的患者出现的不良事件 对于曾接受过治疗的患者,本品的安全性评价是基于来自随机临床试验中安全性数据的汇总分析,临床试验 P018 和 P019 报告了 462 名患者服用本品推荐剂量 400 mg,每日两次合并优化背景疗法 (OBT)治疗,与对照组 237 名接受安慰剂合并 OBT 联合治疗的患者进行比较。在双盲治疗期内,服用本品 400 mg,每日二次组的总随访期为 1051 病人年,而服用安慰剂组为 322 病人年。 在临床试验 P018 和 P019 的汇总显示: 服用本品 400 mg,每日两次+ OBT 组患者(平均随访 118.7 周)和服用安慰剂 + OBT 对照组(平均随访 71.0 周)患者,不考虑不良事件严重程度或因果关系,最常出现的(任一组中>10%)临床不良事件及其发生率分别为:腹泻 26.6%和 24.9%、恶心 13.6%和 16.0%、头痛 12.1%和 13.5%、鼻咽炎14.3% 和 8.9%、疲劳 12.1%和 5.9%、上呼吸道感染 15.8%和 10.1%、支气管炎 12.1%和6.8%、发热 9.7%和 13.9%、呕吐 8.9% 和 11.0%。该汇总分析显示,本品 + OBT 治疗组因不良事件中止治疗的患者(临床和实验室)比例为 4.5%,安慰剂 + OBT 组为5.5%。 与药物相关的不良事件 下表所示的临床不良事件是研究者认为严重程度呈中至重度,且与本品或安慰剂单用或本品或安慰剂合用 OBT 相关: 表1 列出了两个治疗组中的≥2%的曾接受过治疗的成人患者出现的与药物相关的中至重度临床不良事件。 
本品 + OBT治疗组曾接受过治疗的患者(n=462),按照系统器官分类,发生率不到2%的与药物相关的临床中至重度临床不良事件如下: [常见(≥1/100,<1/10),罕见(≥1/1,000,<1/100)] 心脏疾病 罕见:室性早搏 听觉和迷路障碍 罕见:眩晕 眼部疾病 罕见:视力缺损 胃肠道疾病 常见:腹泻,恶心 罕见:腹痛、腹胀、上腹痛、呕吐、便秘、腹部不适、 消化不良、胃肠胀气、胃炎、胃食管返流病,口干燥,嗳气 全身性不适和给药部位异常 常见: 衰弱、疲乏 罕见: 发热、寒战、面部浮肿、外周性水肿 肝胆疾病 罕见:肝炎 免疫系统疾病 罕见: 药物过敏 感染和寄生虫感染 罕见:单纯疱疹,生殖器疱疹、胃肠炎 系统检查结果异常 罕见:体重增加、体重减轻 代谢和营养障碍 罕见: 糖尿病、脂代谢紊乱、食欲增加、食欲减退 肌肉骨骼与结缔组织疾病 罕见:关节痛、肌肉痛、背痛、骨骼肌疼痛、骨质疏松症、多关节炎 神经系统疾病 罕见:头晕、外周神经疾病、感觉异常、嗜睡、紧张性头痛 、震颤 精神疾病 罕见:抑郁、失眠、焦虑 肾脏和泌尿系统疾病 罕见:肾炎、肾石病、夜尿症、肾衰、肾小管间质性肾炎(TIN) 生殖系统和乳腺疾病 罕见:男子女性型乳房 呼吸、胸腔和纵隔疾病 罕见:鼻衄 皮肤和皮下组织疾病 罕见:获得性脂肪营养不良、皮疹、多汗症、 痤疮性皮炎、红斑、脂肪肥大、盗汗、斑疹、斑丘疹、瘙痒疹、皮肤干燥症、痒疹、皮下脂肪萎缩、瘙痒症 严重事件 临床试验报告了下列与药物相关的临床严重不良事件:胃炎、肝炎、肾衰、生殖器疱疹、意外用药过量。 既往未接受治疗患者的不良事件 基于在既往未接受治疗患者中开展的、随机、双盲、活性对照试验(试验方案021)(STARTMRK),对本品进行了如下安全性评估,在该试验中,采用的为本品 400 mg每日两次与固定剂量的恩曲他滨200 mg (+) 泰诺福韦245 mg的联合治疗(N=281),并与依非韦伦 (EFV) 600 mg就寝时间给药+恩曲他滨 (+) 泰诺福韦的联合给药(N=282)进行了比较。在双盲治疗中,本品 400 mg每日两次+ 恩曲他滨 (+) 泰诺福韦组患者的总随访时间为1104病人年,在依非韦仑 600 mg 就寝时间给药+ 恩曲他滨 (+) 泰诺福韦组,总随访时间为1036病人年。 根据 P 值(分别为0.325 和 <0.001),在接受本品患者组,发生的临床不良事件患者百分比及发生药物相关不良事件的患者百分比(%)均低于接受依非韦仑的患者组。在该试验的本品 + 恩曲他滨 (+) 泰诺福韦组,因不良事件而中止(临床和实验室)治疗率为5.0%,在依非韦仑 + 恩曲他滨 (+) 泰诺福韦组,因不良事件而中止治疗率为10.0%。 在本品 400 mg 每日两次给药+ 恩曲他滨 (+) 泰诺福韦的患者组及对照组依非韦仑 600 mg 就寝时间给药+ 恩曲他滨 (+) 泰诺福韦的患者组中发生的所有严重程度并且无论因果关系如何的、最常报告的临床不良事件(在任意一组中的发生率>10%)显示在下面的表2 中。 
中枢神经系统(CNS)事件 在既往未接受治疗患者中(P021),根据具有1个或多个中枢神经系统(CNS)症状(描述见下面)的患者比例进行评估,本品 + 恩曲他滨 (+) 泰诺福韦组的CNS不良事件显著低于依非韦伦 + 恩曲他滨 (+) 泰诺福韦组;在第8周、第48周和第96周,累积事件的p值分别为p <0.001、<0.001和<0.001。在第8周时,在接受本品的治疗组,具有1件或多件CNS症状的患者百分比为20.3%,在接受依非韦伦的治疗组为52.1%;在第48周时,分别为26.3%和58.5%;在第96周时,分别为28.8%和60.6%。这些CNS不良事件包括:头晕、失眠、注意力受损、嗜睡、抑郁、梦魇、意识错乱状态、自杀观念、神经系统异常、精神异常、梦异常、自杀企图、急性精神病、谵妄、意识水平降低、幻觉、幻听、成功自杀和重性抑郁。 药物相关不良事件 下面列出的临床不良反应指的是: 研究者认为与本品或依非韦伦单用有关,或与恩曲他滨 (+) 泰诺福韦的联合治疗有关的中、重度反应。 在表3 中,报告的为任意治疗组中的既往未接受治疗患者中发生率≥2%的中、重度药物相关临床不良反应。 
对于接受 本品 + 恩曲他滨 (+) 泰诺福韦治疗的既往未治疗患者(n=281),将他们的发生率<2%的药物相关的临床不良反应按照系统器官类别列在了下面。 [常见(≥1/100, <1/10),罕见(≥1/1,000, <1/100)] 血液和淋巴系统异常 罕见:淋巴结疼痛、嗜中性粒细胞减少、贫血淋巴结病 耳和迷路异常 罕见:耳鸣、眩晕 胃肠道异常 常见:腹泻、腹痛 罕见:呕吐、上腹痛、消化不良、糜烂性十二指肠炎、胃食管返流疾病、腹胀 全身不适和给药部位异常 常见:乏力、虚弱 罕见:下颌骨肿大 肝胆疾病 罕见:酒精性肝炎 免疫系统异常 罕见:免疫重建综合征 感染与传染病 罕见:带状疱疹、胃肠炎、毛囊炎、淋巴结脓肿 代谢和营养异常 罕见:食欲减退、血胆脂醇过多、体脂肪异常 肌肉骨骼和结缔组织异常 罕见:关节炎、肌痛、肌肉痉挛、颈部疼痛 良性、恶性和非特定肿瘤(包括囊肿和息肉) 罕见:乳腺癌 神经系统异常 常见:头晕 罕见:睡眠过度、嗜睡、记忆损害、失语、注意障碍、震颤 精神异常 常见:梦异常、梦魇、抑郁 罕见:焦虑、精神障碍、意识错乱状态、抑郁、严重抑郁、自杀倾向 肾脏和泌尿系统异常 常见:肾结石 生殖系统和乳腺异常 罕见:勃起功能障碍 皮肤和皮下组织异常 罕见:痤疮、脱发、皮肤损害、脂肪营养不良 严重事件 在临床试验 P021 中接受本品 + 恩曲他滨 (+) 泰诺福韦治疗的既往未接受治疗患者中,报告了下列药物相关严重不良事件:贫血、恶心、免疫重建综合征、精神障碍、自杀倾向、乳腺癌、抑郁。 选择的不良事件 在曾接受过本品加OBT治疗和安慰剂加OBT治疗的患者中观察到癌症事件,其中数例为原有癌症复发。癌症的具体类型和发生率符合重度免疫缺陷人群的特征(许多 患者的CD4+计数低于50个/mm3,且大多数曾被诊断为AIDS)。在这些研究中服用本品和服用对照药物而发生癌症的风险是类似的。 在使用本品治疗的患者(见表2)中观察到2-4级肌酸激酶实验室值异常。已报告有肌病和横纹肌溶解的发生。对于肌病或横纹肌溶解风险增加的患者,如同时服用了已知能导致这些疾病的其他药物的患者,需谨慎使用本品。 在曾接受过治疗的患者中,与单用本品不包括 darunavir 或单用 darunavir 不包括本品的患者两组相比,接受本品+ darunavir 的治疗组较易发生皮疹。但是,被认为与药有关的皮疹发生率三组是相似的。这些皮疹发生程度比较轻并且可以缓解,不会限制治疗;没有由于皮疹而终止治疗的事件。在既往未接受治疗患者中,与依非韦伦+恩典他滨+泰诺福韦组相比,本品+恩典他滨+泰诺福韦组较少发生皮疹。 混合存在状况的病人 混合感染乙肝和/或丙肝病毒的患者在 III期试验中,允许纳入伴有慢性(非急性)活动性乙肝和/或丙肝混合感染的患者曾接受过治疗的(N=114/699 或 16%)和既往未接受治疗患者(N = 34/563 或6%),只要其基线肝功能指标没有超过正常值上限的 5 倍。尽管在两个组的乙肝和/或丙肝混合感染患者亚组中,AST 和 ALT 的异常率稍高,但总的来说,本品的安全性在乙肝和/或丙肝混合感染患者与非乙肝和/或丙肝混合感染患者中基本一致。 儿童的不良反应 在IMPAACT P1066 中研究了本品联合其它抗逆转录病毒药物治疗 126 名接受过抗 逆转录病毒治疗的 2-18 岁儿童和青少年(详见儿童用药和药理学,临床研究)。126名患者中有 96 名接受了推荐剂量的本品。 这 96 名儿童和青少年第 24 周的药物相关不良反应发生率、种类和严重程度与成人相当。 1名患者发生了药物相关的临床不良反应,包括 3 级精神运动功能活动过度、行为异常和失眠。1 名患者发生了药物相关的 2 级过敏性皮疹。 1名患者发生了药物相关的严重实验室异常,4 级 AST 和 3 级 ALT。
上市后经验 不考虑因果关系在上市后经验中已报告下列其他不良经验: 血液和淋巴系统障碍 血小板减少症 肝胆疾病 潜在肝疾病和或合并用药患者的肝功能衰竭(有或没有相关的过敏症) 肌肉骨骼和结缔组织疾病 横纹肌溶解症 神经系统疾病 小脑性共济失调 精神异常 抑郁(尤其是在原先存在精神疾病史的患者中),包括自杀观念和行为。 皮肤和皮下组织疾病 Stevens-Johnson综合征,伴有嗜酸性粒细胞增多和全身症状的药物性皮炎(DRESS)。 实验室检查结果 实验室异常 在临床试验 P018 和 P019 中接受本品 400 mg 每日两次给药或接受安慰剂(均接 受了 OBT)的患者中,有关具有选定的 2 级~4 级实验室检查异常、并且与基线相比加重的患者百分比见表 4。 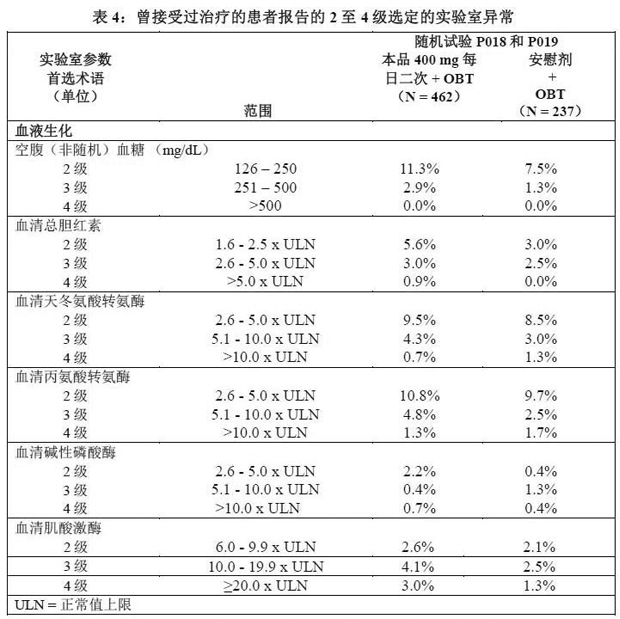
在 P021 的接受本品 400 mg 每日两次给药或依非韦伦(均合并恩曲他滨 (+) 泰诺福韦)的既往未接受治疗成人患者中,具有 2~4 级选定实验室检查异常、并且与基线相比发生了加重的患者百分比报告于表 5。 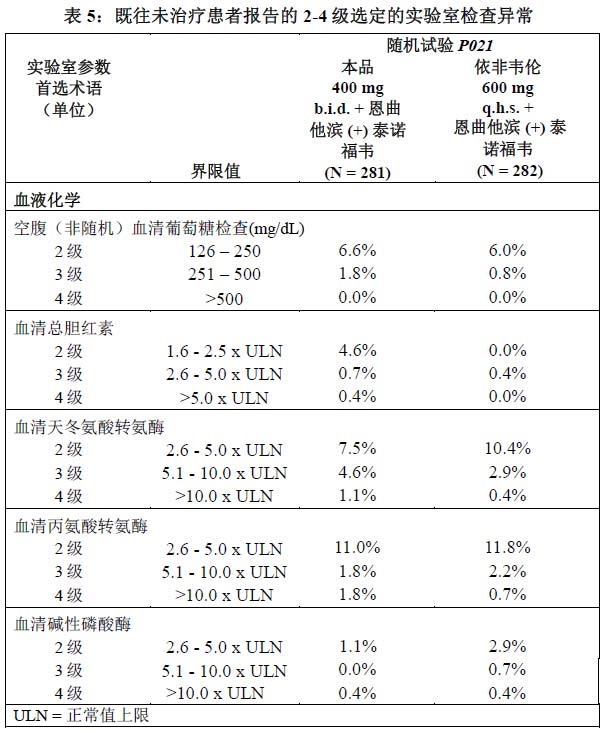
血脂相对于基线变化 试验 P021 的空腹血脂的相对于基线变化显示在表 6。 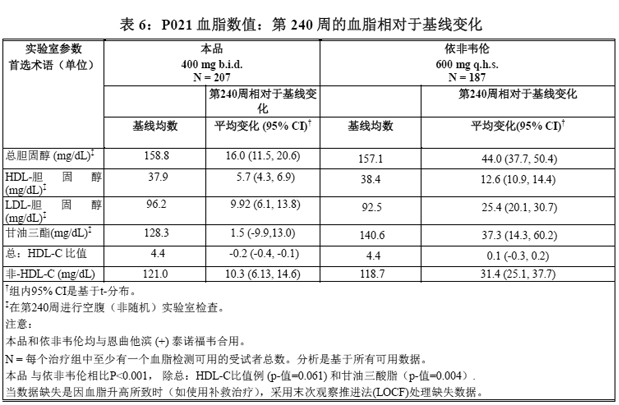
|
||
| 禁忌症 | 本品禁用于对任何成份过敏的患者。 |
官方微信公众号:39健康网
邮箱:ypk@mail.39.net
客服QQ:2308406323(不提供购买服务)
发邮件请备注修改药品价格信息&媒体合作&市场合作

39AI全科医生
疾病诊断 医学咨询
深度学习海量医学知识和病例
网站简介 | 媒体报道 | 网络营销 | 产品中心 | 人才招聘 | 联系方式 | 手机浏览
互联网药品信息服务资格证书 编号:(粤)-经营性-2012-0002
根据国家相关法律法规,药品通仅提供药品基本查询信息及购买信息展示服务,不提供药品交易服务,药品通相关药品价格信息来自具备合法资质的网上药店。
药品通仅提供药品信息展示服务,不提供任何药品交易服务,价格信息均来自具备合法资质的网上药店。药品通所展示药品信息仅供医学药学专业人士阅读、参考。
如药品、产品信息与您实际购买的信息不同,请以实际购买信息为准。请仔细阅读药品、产品说明书或者在药师、医务人员指导下购买和使用,禁忌内容或者注意事项详见说明书。
Copyright © 2000- 39.net All Rights Reserved. 39健康网 版权所有